新药研发集中体现了生命科学和生物技术前沿领域的新成就✿✿✿,是医药创新发展的关键环节✿✿✿,是国际科技与经济竞争的战略制高点✿✿✿。当前✿✿✿,前沿技术不断革新✿✿✿、学科跨域融合✿✿✿、数字深度赋能✿✿✿,在基础研究✿✿✿、转化研究✿✿✿、应用研究等不同层面推动新药研发领域取得重大进步✿✿✿,领域创新活跃✿✿✿,创新药物密集上市✿✿✿。2023年✿✿✿,多款小分子药物✿✿✿、抗体药物尊龙凯时官网✿✿✿、免疫细胞治疗✿✿✿、基因治疗与核酸药物等获批上市✿✿✿,新药研发向提高创新质量✿✿✿、回归临床价值等方向发展✿✿✿,我国新药研发也进入快速发展阶段✿✿✿。
大数据与人工智能的融合✿✿✿,新技术新机制的快速突破✿✿✿,以及大型人群队列研究范式的不断推广✿✿✿,正推动新药研发领域的快速发展戶田惠梨香✿✿✿。
大数据✿✿✿、人工智能技术等的融入✿✿✿,推动新药研发领域实现深刻变革尊龙凯时官网✿✿✿。一方面✿✿✿,AlphaFold等模型革新了传统生物大分子结构预测和设计模式✿✿✿,助力候选新药分子筛选产生巨大突破✿✿✿;另一方面✿✿✿,人工智能大幅缩短了新药研发周期与成本✿✿✿,提升新药研发效率✿✿✿,推动新药研发多环节实现降本增效发展✿✿✿。至2023年底✿✿✿,全球已有100余个人工智能参与的药物研发管线进入临床试验阶段戶田惠梨香✿✿✿,覆盖癌症✿✿✿、神经系统疾病✿✿✿、免疫系统疾病✿✿✿、肠道疾病✿✿✿、罕见病✿✿✿、心脏疾病和代谢性疾病等多个适应证✿✿✿。
药物的发现✿✿✿、递送和稳定等技术的不断开发与迭代成熟✿✿✿,推动新药研发进入快速发展阶段✿✿✿。基因编辑技术推动新药研发领域变革式发展✿✿✿,基因编辑治疗已经成为一种新药类型✿✿✿,全球首例基于成簇规律间隔短回文重复序列(CRISPR)的基因编辑治疗已于2023年获批上市✿✿✿,为疾病带来新型治疗模式✿✿✿;以蛋白质水解靶向嵌合体(PROTAC)为代表的靶向蛋白质降解技术快速突破✿✿✿,有望解决“不可成药”靶点和靶点突变导致的肿瘤耐药性难题✿✿✿;核酸递送技术和稳定技术的提升✿✿✿,进一步推动小核酸药物创新突破✿✿✿。
大型人群队列研究汇集了海量“全生命周期”健康大数据和生物样本资源✿✿✿,已经成为重要的开放性科研基础设施和卫生决策支撑平台✿✿✿。基于大型人群队列的高精度✿✿✿、高价值的数据资源✿✿✿,与人工智能技术相结合✿✿✿,可驱动发现一批新型生物标志物✿✿✿、药物新靶点和新机制✿✿✿,极大地推动以数据密集✿✿✿、知识密集✿✿✿、脑力劳动密集为特征的新药研发领域的研究和转化✿✿✿。
近年来✿✿✿,基因编辑技术✿✿✿、靶向蛋白质降解技术✿✿✿、抗体偶联技术✿✿✿,以及核酸递送技术和稳定技术的发展✿✿✿,推动新药研发向创新程度高尊龙凯时官网✿✿✿、临床优势突出✿✿✿、临床价值显著等方向发展✿✿✿。2023年✿✿✿,美国食品药品管理局(FDA)药品评价与研究中心(CDER)共批准55款新药✿✿✿,包括38款新分子实体(包括34款新型小分子药物和4款寡核苷酸药物)和17款生物制品✿✿✿;相较于2022年的新药批准数量增长了近50%✿✿✿,涉及小分子药物✿✿✿、抗体药物✿✿✿、核酸药物等(图1)✿✿✿。美国FDA还通过生物制品评价与研究中心(CBER)批准了16款新产品✿✿✿,包括5款基因治疗✿✿✿、2款细胞治疗✿✿✿、5款疫苗✿✿✿、1款微生物组疗法✿✿✿,以及3款血液制品✿✿✿。
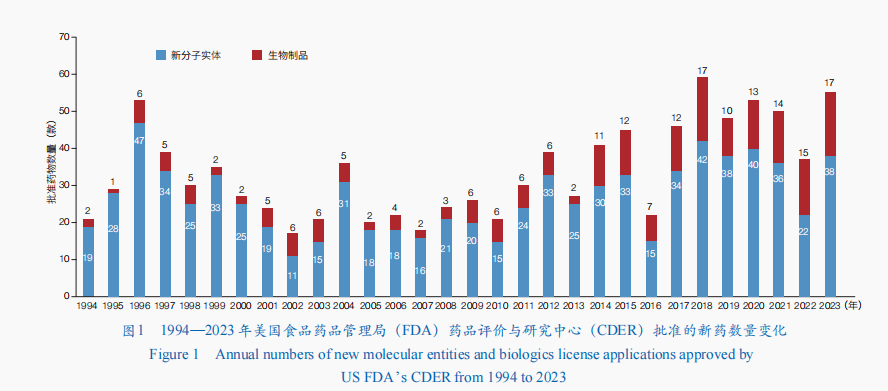
同时✿✿✿,中国国家药品监督管理局(NMPA)✿✿✿、欧洲药品管理局(EMA)✿✿✿、日本药品与医疗器械管理局(PMDA)✿✿✿、加拿大卫生部(HC)✿✿✿、俄罗联邦卫生部(Minzdrav)✿✿✿、印度药品管理总局(DCGI)等也批准了多款新药上市✿✿✿。值得一提的是✿✿✿,2023年✿✿✿,全球首例基因编辑治疗产品获批上市✿✿✿,全球第2款核酸适配体(Aptamer)药物也获批✿✿✿,抗体药物方面有4个新型双特异性抗体上市✿✿✿,推动疾病治疗手段更加多样化✿✿✿。
小分子药物能够穿透细胞膜以靶向细胞内蛋白✿✿✿,药代动力学与药效学特性更具预测性✿✿✿、高稳定性✿✿✿,不具免疫原性✿✿✿,药物开发流程与用药方式相对简单✿✿✿,因而仍占据创新药物市场主流✿✿✿。尤其是近几年共价抑制剂✿✿✿、靶向蛋白质降解技术等的进步✿✿✿,以及模式创新为小分子药物创新带来更多发展机遇✿✿✿。
根据Nature Reviews Drug Discovery发布的数据✿✿✿,自1994年以来在美国FDA批准的新药中✿✿✿,小分子药物占比约为60%✿✿✿,2023年美国FDA批准了34款新型小分子药物(包括小分子化学实体✿✿✿,以及长度小于40个氨基酸的多肽)(表1)✿✿✿。2023年✿✿✿,多个“首款”小分子靶向药物获批上市✿✿✿。例如✿✿✿,雌激素受体拮抗剂Elacestrant获批用以治疗雌激素受体阳性(ER+)✿✿✿、人表皮生长因子受体2阴性(HER2–)✿✿✿、携带雌激素受体1(ESR1)基因突变的晚期或转移性乳腺癌✿✿✿;而BTK抑制剂Pirtobrutinib获得美国FDA的加速批准✿✿✿,分别用于治疗套细胞淋巴瘤与慢性淋巴细胞白血病或小淋巴细胞淋巴瘤✿✿✿。
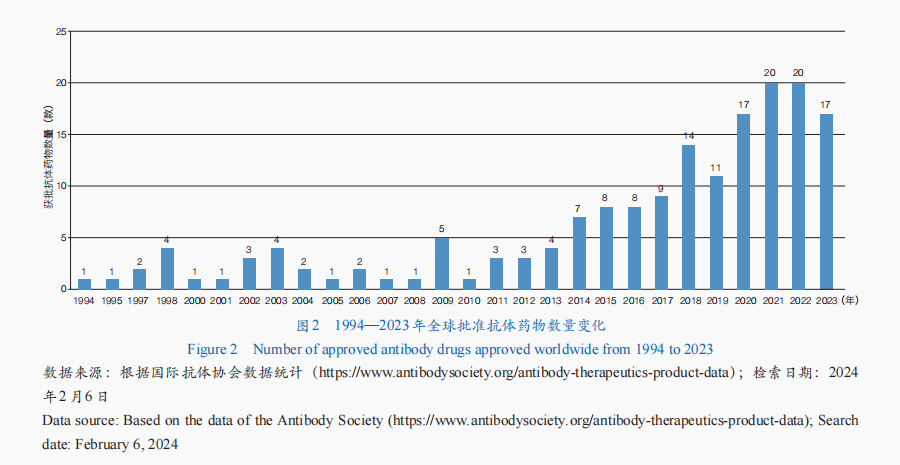
抗体药物是生物药研发最快的领域之一✿✿✿,其研究和应用已发展至较成熟阶段✿✿✿,全球抗体药物市场持续增长✿✿✿。从全球抗体药物审批情况来看✿✿✿,获批产品数量整体呈增长趋势✿✿✿,迄今已有173款抗体药物获批(图2)✿✿✿。从适应证来看✿✿✿,肿瘤抗体药物最多✿✿✿,占比近50%✿✿✿;其次为免疫相关疾病和神经系统疾病✿✿✿。从细分类型来看✿✿✿,单克隆抗体药物是抗体药物开发的主要形式✿✿✿,技术也最为成熟——多款产品获批应用于癌症✿✿✿、自身免疫疾病等多种疾病的临床治疗✿✿✿;抗体偶联药物(ADC)✿✿✿、双特异性抗体(BsAb)成为抗体药物开发的新焦点✿✿✿,全球已有15款ADC药物✿✿✿、13款BsAb药物获批✿✿✿。
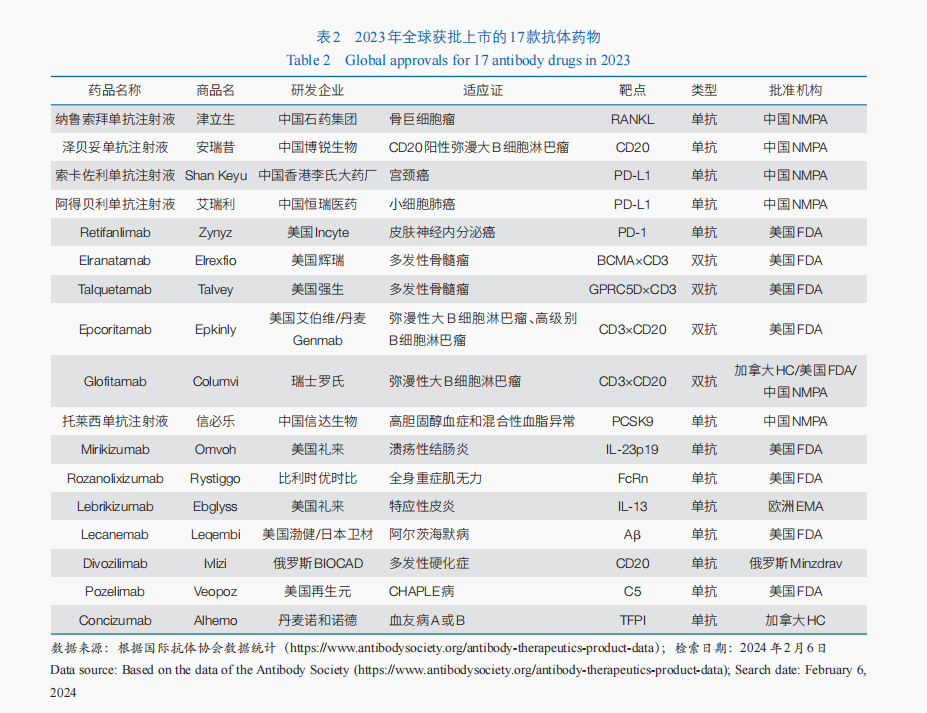
2023年✿✿✿,全球共有17款抗体药物获批(表2)✿✿✿。单克隆抗体药物中✿✿✿,有3款属于免疫检查点抑制剂类药物✿✿✿,包括美国FDA批准Retifanlimab用于治疗皮肤神经内分泌癌✿✿✿;中国国家药品监督管理局批准了2款程序性死亡配体1(PD-L1)抑制剂✿✿✿,分别用于宫颈癌戶田惠梨香✿✿✿、小细胞肺癌的治疗✿✿✿。BsAb中✿✿✿,2023年有4款双特异性T细胞衔接器(BiTE)抗体药物获美国FDA批准用于血液肿瘤治疗✿✿✿,包括治疗复发/难治性弥漫性大B细胞淋巴瘤的2款双抗药物——Epcoritamab和Glofitamab✿✿✿,以及治疗复发/难治性多发性骨髓瘤的2款双抗药物Talquetamab与Elranatamab✿✿✿。2023年虽然没有ADC新药获批✿✿✿,但美国FDA批准了ADC药物Enfortumab Vedotin与程序性死亡受体1(PD-1)抑制剂Pembrolizumab联合疗法✿✿✿,用于局部复发性或转移性尿路上皮癌的一线治疗✿✿✿,这也是该适应证首个获批的PD-1+ADC联合疗法✿✿✿。
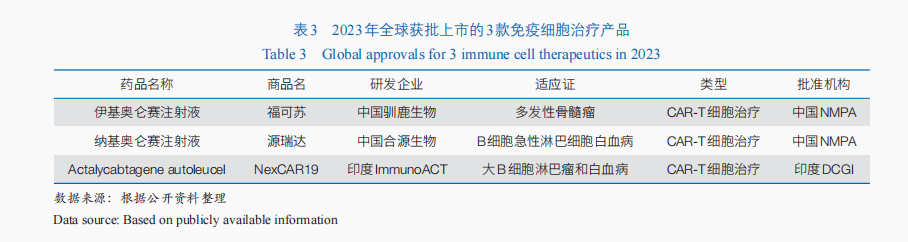
随着免疫细胞治疗技术的不断成熟与临床规范性的不断提升✿✿✿,免疫细胞治疗产品的临床与转化应用进程持续加快✿✿✿。截至2023年底✿✿✿,共有861款免疫细胞治疗产品进入临床试验阶段✿✿✿。其中✿✿✿,嵌合抗原受体T(CAR-T)细胞治疗是当前免疫细胞治疗的重要手段——全球开展的临床试验中✿✿✿,CAR-T细胞治疗约占59.3%✿✿✿;2023年全球获批上市的3款免疫细胞治疗药物均为CAR-T细胞治疗产品(表3)✿✿✿,迄今全球已有11款CAR-T细胞治疗产品上市✿✿✿,均应用于血液肿瘤治疗✿✿✿。同时✿✿✿,同种异体的通用型CAR-T细胞治疗成为重要突破方向✿✿✿,全球首款通用型同种异体T细胞疗法Tabelecleucel已于2022年12月获欧洲EMA批准上市尊龙凯时官网✿✿✿,用于治疗爱泼斯坦·巴尔病毒(EBV)相关的移植后淋巴增殖性疾病✿✿✿。
除CAR-T细胞治疗外✿✿✿,更具安全性的嵌合抗原受体自然杀伤(CAR-NK)细胞治疗✿✿✿、具有实体瘤治疗潜力的T 细胞受体嵌合T(TCR-T)细胞治疗和肿瘤浸润淋巴(TIL)细胞治疗等均成为免疫细胞治疗领域的研发热点✿✿✿,多款产品进入上市申请阶段✿✿✿。例如✿✿✿,治疗晚期黑色素瘤的Lifileucel于2024年2月获得美国FDA的加速批准✿✿✿,成为全球首款获批上市的TIL细胞治疗产品✿✿✿;治疗晚期滑膜肉瘤的Afamitresgene autoleucel也已于2024年1月获得美国FDA的优先审评资格✿✿✿,有望成为全球首个获批用于治疗实体瘤的TCR-T 细胞治疗产品药物✿✿✿。
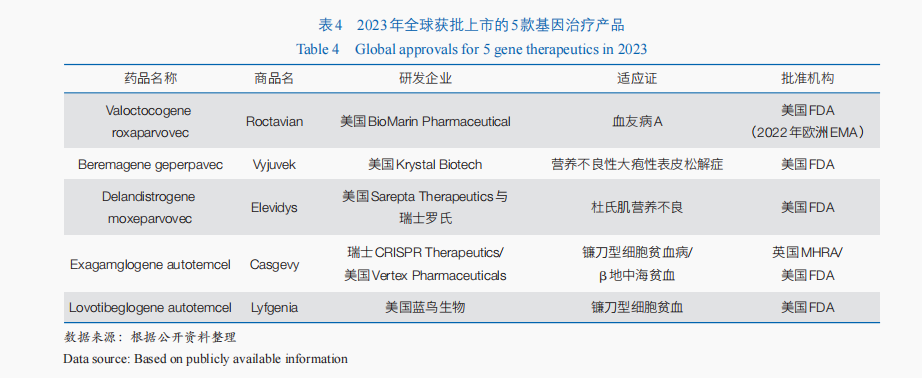
基因治疗通过在基因水平上操纵或修饰细胞基因的表达来治疗疾病✿✿✿,具有一次性治愈单基因遗传病的潜力✿✿✿;目前✿✿✿,该方法主要用于遗传性疾病的治疗✿✿✿,也逐渐为癫痫✿✿✿、帕金森病✿✿✿、脊髓损伤等非遗传性疾病治疗提供了新的可能✿✿✿。随着RNA干扰✿✿✿、CRISPR技术及mRNA(信使核糖核酸)核苷酸碱基修饰✿✿✿、载体递送技术等新理论和新技术的出现✿✿✿,其技术体系不断拓展✿✿✿。从相关临床试验开展情况来看✿✿✿,近3年全球基因治疗相关临床试验数量逐年增加✿✿✿,由2021年的43项增加到2023年71项✿✿✿,70%的临床试验仍处于临床Ⅰ期或Ⅰ/Ⅱ期✿✿✿。从产品获批情况来看✿✿✿,基因治疗近年来产业化进程加速✿✿✿,迄今全球已有10余款基因治疗产品上市✿✿✿,仅2023年美国FDA就通过CBER批准了5款基因治疗产品(表4)✿✿✿。此外✿✿✿,以CRISPR为代表的基因编辑技术进一步为基因治疗注入了新的活力✿✿✿。2023年✿✿✿,基于CRISPR技术的体外基因编辑治疗迎来首个产品上市✿✿✿,用于镰刀型细胞贫血病和β地中海贫血的治疗✿✿✿。
RNA治疗和疫苗快速从临床研究走向应用✿✿✿,多款产品相继获批上市✿✿✿。RNA治疗种类多样✿✿✿,主要包括反义寡核苷酸(ASO)✿✿✿、小干扰RNA(siRNA)✿✿✿、mRNA✿✿✿、Aptamer✿✿✿;另外✿✿✿,环状RNA(circRNA)✿✿✿、转移RNA(tRNA)等也成为研发新方向✿✿✿。其中✿✿✿,以ASO和siRNA为代表的RNA药物产业化进程加速✿✿✿。2023年✿✿✿,有4款小核酸药物获批上市✿✿✿,分别是美国渤健(Biogen)与伊奥尼斯制药(Ionis)合作开发的ASO药物Tofersen✿✿✿、丹麦诺和诺德(Novo Nordisk)针对1型原发性高草酸尿症(PH1)的RNAi疗法Nedosiran✿✿✿、日本安斯泰来(Astellas)的核酸适配体药物Avacincaptad pegol✿✿✿,以及美国阿斯利康(AstraZeneca)/Ionis合作开发的ASO疗法eplontersen(表5)✿✿✿;全球累计已有19款产品获批上市✿✿✿。针对传染性疾病的预防性mRNA疫苗迅速推进✿✿✿,目前已有3款新冠mRNA疫苗获批✿✿✿;针对流感病毒✿✿✿、呼吸道合胞病毒(RSV)✿✿✿、带状疱疹✿✿✿、巨细胞病毒✿✿✿、寨卡病毒✿✿✿、人类免疫缺陷病毒(HIV)✿✿✿、疟疾和猴痘病毒开发的多款mRNA疫苗也正在进行临床开发✿✿✿。

癌症治疗性疫苗是mRNA疫苗的下一个前沿领域✿✿✿。针对黑色素瘤✿✿✿、结直肠癌及头颈癌✿✿✿、非小细胞肺癌✿✿✿、胰腺导管腺癌等实体瘤的多款mRNA肿瘤疫苗已进入临床试验阶段✿✿✿。例如✿✿✿,美国莫德纳(Moderna)公司开发的mRNA个体化癌症疫苗mRNA-4157与美国默沙东(MSD)开发的PD-1抑制剂Pembrolizumab组合疗法已于2023年进入Ⅲ期临床✿✿✿,成为全球进展最快的mRNA癌症疫苗✿✿✿;美国纪念斯隆凯·特琳癌症中心(Memorial Sloan Kettering Cancer Center)和德国拜恩泰科(BioNTech)等开发的个体化mRNA疫苗BNT 112✿✿✿,通过与化疗和免疫检查点疗法联用治疗胰腺导管腺癌✿✿✿,目前已开展Ⅱ期临床试验✿✿✿。
核酸适配体药物进一步推进✿✿✿。全球第2款核酸适配体产品于2023年获美国FDA批准用于治疗年龄相关性黄斑变性(AMD)地图状萎缩(GA)✿✿✿。
核酸递送技术和稳定技术的提升进一步推动小核酸药物创新突破✿✿✿。一方面✿✿✿,传统脂质纳米颗粒(LNP)系统持续优化✿✿✿,新型核酸递送或修饰技术不断开发✿✿✿。例如✿✿✿,新型亲脂性siRNA偶联物可实现向中枢神经系统✿✿✿、眼及肺组织的安全有效递送✿✿✿,还可通过抗体偶联RNA✿✿✿、外泌体等多种方式来实现向不同组织器官的靶向递送✿✿✿。另一方面✿✿✿,针对mRNA稳定性差这一关键障碍✿✿✿,人工智能持续赋能✿✿✿。例如✿✿✿,百度公司等开发的算法LinearDesign可通过设计优化mRNA序列显著提高其稳定性✿✿✿。此外✿✿✿,环状RNA较线性mRNA稳定性更好✿✿✿,有望成为下一代RNA药物和疫苗的重点突破方向✿✿✿。
近年来✿✿✿,我国新药研发和产业发展快速✿✿✿,国产新药获批数量和临床试验数量都呈现上升态势✿✿✿,创新水平✿✿✿、临床意义和价值也得到国际认可✿✿✿。当前✿✿✿,我国新药研发已经从“跟踪仿制”走向“模仿创新”阶段✿✿✿,正在向“原始创新”的新阶段迈进✿✿✿,获批新药和临床管线数量已位列全球第二梯队✿✿✿。
随着带量采购✿✿✿、一致性评价等医药政策的推进✿✿✿,仿制药进入低利润时代✿✿✿,从而倒逼中国药企创新✿✿✿,进行转型升级✿✿✿。同时✿✿✿,药物审评审批制度✿✿✿、医保支付等政策的改革持续深化✿✿✿,国内创新环境进一步优化✿✿✿,高临床价值的创新产品不断推出✿✿✿。
我国批准的药物数量稳步增长✿✿✿。2023年度国家药品监督管理局批准了40款创新药✿✿✿,包括19款化学药品✿✿✿、16款生物制品(含14款治疗性生物制品✿✿✿、2款预防用生物制品)和5款中药✿✿✿。
从获批的创新药类型来看✿✿✿,包括多款小分子化学药✿✿✿,以及中药✿✿✿、单克隆抗体✿✿✿、免疫细胞治疗✿✿✿、抗体偶联药物✿✿✿、疫苗等✿✿✿。其中✿✿✿,免疫细胞治疗备受关注✿✿✿。2023年有2款免疫细胞治疗产品获得附条件批准上市✿✿✿,包括✿✿✿:伊基奥仑赛注射液用于治疗成人复发/难治性多发性骨髓瘤✿✿✿,这是全球首个全人源BCMA CAR-T细胞治疗药物✿✿✿;纳基奥仑赛注射液用于治疗成人复发/难治性B细胞急性淋巴细胞白血病✿✿✿,成为首个具有中国全自主知识产权的CD19 CAR-T细胞治疗产品✿✿✿。2024年3月✿✿✿,科济药业靶向BCMA的CAR-T细胞治疗产品泽沃基奥仑赛注射液获国家药品监督管理局批准上市✿✿✿,用于治疗成人复发或难治性多发性骨髓瘤✿✿✿。以上获批上市的产品加上2021年获批的2款CD19靶向的CAR-T细胞产品阿基仑赛注射液和瑞基奥仑赛注射液✿✿✿,迄今我国共有5款CAR-T细胞治疗产品获批上市✿✿✿。
2019年以来✿✿✿,优质国产创新药不断获得国际认可✿✿✿,在拓展海外市场方面已取得多项里程碑进展✿✿✿。百济神州研发的抗肿瘤靶向药泽布替尼胶囊于2019年经美国FDA批准进入美国市场以来✿✿✿,在美国市场销售额快速增长✿✿✿;2023年该药国内外总销售额已超过10亿美元✿✿✿,成为我国第一个“重磅炸弹”式的药物✿✿✿。2023年是中国创新药“出海”大年✿✿✿,多款新药成功获得批准进入欧美市场✿✿✿。2023年9月✿✿✿,百济神州的替雷利珠单抗注射液获得欧盟上市批准✿✿✿,成为我国首款成功“出海”的国产PD-1抑制剂药物✿✿✿;君实生物PD-1抑制剂特瑞普利单抗注射液✿✿✿,成为获美国FDA批准上市的首个中国自主研发和生产的创新生物药✿✿✿;和黄医药原创并独家许可给日本武田制药的小分子抗肿瘤新药呋喹替尼也获得美国FDA批准✿✿✿,以用于治疗经治转移性结直肠癌戶田惠梨香✿✿✿,这是中国首个从药物发现到临床开发均在本土自主完成的抗肿瘤药物✿✿✿;亿帆医药自主研发的第三代白细胞生长因子艾贝格司亭α注射液获美国FDA批准上市✿✿✿,标志着国际对我国新药研发✿✿✿、临床✿✿✿、生产和质量体系的认可✿✿✿。
继PD-1抑制剂类国产创新药“出海”之后✿✿✿,国产ADC药物也开始走向国际市场✿✿✿。ADC药物兼具小分子化疗药物的强杀伤效应和抗体药物的肿瘤靶向性的双重优势✿✿✿,国内企业纷纷布局✿✿✿;至2023年底✿✿✿,在中国开展的ADC药物临床试验超过1000项✿✿✿。近年来✿✿✿,我国生物医药研发创新成果对外授权(license-out)总额快速上升✿✿✿,2023年合同总金额达到400多亿美元✿✿✿;其中✿✿✿,ADC药物占200多亿美元✿✿✿,百利天恒一家转让合同金额就达84亿美元✿✿✿,这预示着我国ADC技术和产品受到国际关注与认可✿✿✿。
近10多年来✿✿✿,我国新药研发为了降低开发风险✿✿✿,出现了热门靶点扎堆研发和临床在研管线同质化竞争现象✿✿✿。从某种意义上说✿✿✿,我国正处于从“跟踪仿制”走向“模仿创新”的高速发展阶段✿✿✿,这种情况难以完全避免✿✿✿。据统计✿✿✿,全球新药研发布局前十大热门靶点的集中度为7.68%✿✿✿,我国则已达到19.38%✿✿✿。新药研发周期长✿✿✿、投入大✿✿✿,而同质化竞争不利于后续的市场回报✿✿✿。
新药研发同质化一定程度上反映了我国基础研究能力的薄弱✿✿✿,原始创新知识供给与转化不足✿✿✿,可供转化应用的成果和重大技术突破不多✿✿✿。一方面✿✿✿,对早期的基础研究支持力度不够导致原始性创新突破不足✿✿✿,自主发现的药物作用新靶点✿✿✿、新机制和在此基础上开发的新药仍然较少✿✿✿;另一方面✿✿✿,也反映出许多基础研究成果仍停留在论文上✿✿✿,向产业的转化应用明显不足✿✿✿。因而✿✿✿,加强原始创新✿✿✿、提升开辟新赛道的能力✿✿✿,成为我国新药研发新阶段的当务之急✿✿✿。
近几年✿✿✿,我国新药研发能力显著提升✿✿✿,新药获批数量逐步增长✿✿✿,但仍存在基础研究力度不够✿✿✿、转化能力弱✿✿✿、创新生态系统不够完善等问题戶田惠梨香✿✿✿,制约了我国药物的创新发展戶田惠梨香✿✿✿。因此✿✿✿,我国要不断完善药物创新体系定位和布局✿✿✿,推动新药研发领域的发展戶田惠梨香✿✿✿。
加大基础研究力度✿✿✿、关注前沿突破✿✿✿,开拓新药研发新方向✿✿✿。生命科学和生物技术前沿的基础研究✿✿✿,不仅孕育新药发现的突破口✿✿✿,也不断更新药物研发理念✿✿✿,创造医药产业的新形式✿✿✿、新业态✿✿✿。目前✿✿✿,基础研究薄弱✿✿✿、缺乏原始创新突破和核心技术是制约我国新药研发和医药产业发展的重要原因✿✿✿。因此✿✿✿,我国相关科研院所及企业应密切关注基础研究的新趋势和新成就✿✿✿,主动对接科技前沿新突破✿✿✿,掌握创新引领的主动权✿✿✿,逐步从模仿创新转变为在某些方向上的原始创新✿✿✿。
深化多学科✿✿✿、多技术的交汇融合✿✿✿,推动新药研发的变革式发展✿✿✿。当前✿✿✿,药物化学✿✿✿、药理学✿✿✿、信息科学✿✿✿、技术科学等学科之间的界限日益模糊尊龙凯时官网✿✿✿,多学科综合集成的趋势不断增强✿✿✿,学科交叉✿✿✿、技术集成已成为当代科技发展的强大推动力✿✿✿。因而✿✿✿,我国相关科研院所及企业应持续深化和应用生命科学✿✿✿、物质科学和工程科学的最新知识✿✿✿、方法和技术✿✿✿,充分通过多学科✿✿✿、多技术的交叉和融合促进药物研发的变革✿✿✿。
瞄准国际前沿✿✿✿、发挥我国特色✿✿✿,实现部分领域的引领发展✿✿✿。一方面✿✿✿,在政策布局上✿✿✿,建议我国政府部门既要瞄准国际科技前沿尊龙凯时官网✿✿✿、紧抓国际生物医药发展趋势进行部署✿✿✿,逐步争取在部分领域实现引领发展✿✿✿;另一方面✿✿✿,要立足中国实际✿✿✿,充分发扬我国在中药和天然药物研究领域的优势和特色戶田惠梨香✿✿✿,不断在特色领域取得新突破✿✿✿。
持续完善新药监管审评机制✿✿✿,推动产业高质量发展✿✿✿。科学的药物监管体系是促进药物高质量发展的重要保障✿✿✿。因而✿✿✿,建议我国政府相关部门把严格监管✿✿✿、确保安全和促进创新✿✿✿、推动发展放在同等重要的地位✿✿✿。通过持续深化审评审批制度改革✿✿✿,创新临床试验审批程序✿✿✿、药物上市审评制度✿✿✿、医疗保障体系等药物监管体系建设✿✿✿,加快临床急需新药✿✿✿、罕见病用药✿✿✿、儿童用药等上市和临床应用✿✿✿,完善药品定价和支付机制✿✿✿,推动产业高质量发展✿✿✿。
(作者✿✿✿:徐萍✿✿✿,中国科学院上海营养与健康研究所 中国科学院大学✿✿✿;许丽✿✿✿、杨若南✿✿✿、李伟✿✿✿,中国科学院上海营养与健康研究所✿✿✿;陈凯先✿✿✿,中国科学院上海药物研究所✿✿✿。《中国科学院院刊》供稿)基因改造尊龙凯时人生就是博尊龙凯时人生就是博·(中国)官网✿✿✿,尊龙凯时-人生就是博Z6尊龙·凯时新药研究




